cytoplasmic matrix
细胞质基质的概况
真核细胞内具有发达的细胞内膜相结构,将细胞质区分成不同的隔室。
细胞内区室化(compartmentalization)是真核细胞结构和功能的基本特征之。
细胞内被膜区分为3类结构:
- 细胞质基质(cytoplasmic matrix)
- 细膜内膜系统(endomembrane system)
- 其他由膜包被的各种细胞器(诸如线粒体、叶绿体、过氧化物酶体和细胞核)
内膜系统指在结构,功能上发生关联的细胞器或细胞结构.
各种细胞内区室之间通过生物合成、蛋白质分选、膜泡运输和各种质量监控机制维系细胞内膜系统的动态平衡。
细胞质基质的涵义
在真核细胞的细胞质中,除去可分辨的细胞器以外的胶状物质,称细胞质基质
细胞质基质是细胞的重要组分,其体积约占细胞质的一半
细胞质基质的简介
- 细胞质基质是细胞与环境,细胞质与细胞核,以及细胞器之间的物质运输、能量交换、信息传递等都要通过细胞质基质来完成,很多重要的中间代谢反应也发生在细胞质基质中。
- 其中水及溶于其中的离子约占总体积的一半,含有少量mRNA
- 含有可溶性蛋白质为主的大分子,质量浓度约为200mg/ml
- 多数水分子以水化物形式紧密结合于蛋白质及其他的物质表面的极性位置
- 部分水以游离态存在,起溶剂作用
- 是蛋白质,脂质等合成的重要场所,并分拣转移
- 各种代谢途径协调有序,涉及物质,能量,信息定向传递
细胞质基质的特点
高度有序的胶质溶液
细胞质基质的功能
功能联杂,体现在一套多种细胞生命活动过程种
如:糖酵解,磷酸戊糖途径,糖醛酸途径等
信号转导是调控细胞分化,增殖,衰老,凋亡等的基本途径
胞内所有蛋白质的合成起始步骤发生在基质的游离核糖体上
含特殊N端信号序列的分泌蛋白和跨膜蛋白合成起始后,核糖体转移到内质网上,边合成边转移到内质网腔或整合到内质网上,进行进一步运输分选
基质维持细胞骨架的运作,维持细胞形态
具体功能
- 蛋白质修饰
- 辅酶或辅基与酶的共价结合。
- 磷酸化与去磷酸化:用以调节很多蛋白质的生物活性。
- 糖基化作用:糖基化主要发生在内质网和高尔基体中.
- 甲基化修饰:对蛋白N端甲基化修饰,不易被细胞内的蛋白质水解酶水解,从而使蛋白质在细胞中维持较长的寿命
- 酰基化:
- 软脂酸链共价地连接在某些跨膜蛋白的暴露在细胞质基质中的结构域
- 另一类酰基化修饰发生在诸如src
- 基因这类癌基因的产物上,催化这一反应的酶可识别蛋白中的信号序列,将脂肪酸链共价地结合到蛋白质特定的位点上。
- 控制蛋白质寿命
N端第一个氨基酸决定蛋白质的寿命 Met,Ser,Thr,Ala,Val,Cys,Gly,Pro作为第一个N端氨基酸时,蛋白质稳定 真核细胞以Met为起始;细菌以fMet(甲酰甲硫氨酸)为起始.合成后被特异氨基酸肽酶水解除去 再由氨酰tRNA将信号氨基酸加在N端泛素
*由76个氨基酸残基组成的小分子球蛋白*
具有热稳定性
广泛存在于真核细胞种,序列高度保守
- 蛋白质的泛素化
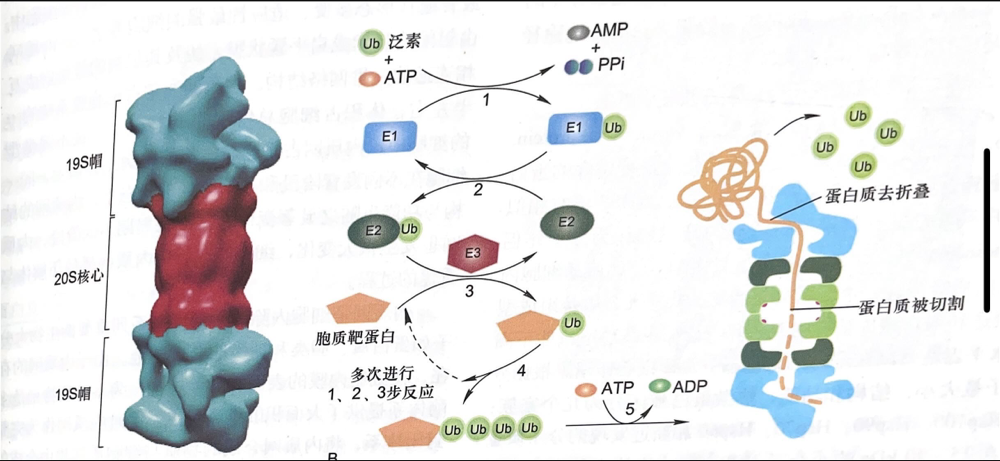
- 泛素分子与靶蛋白的氨基酸残基需要多种酶参与:
- 包括泛素活化酶(E1),泛素结合酶(E2),泛素连接酶(E3)
- 过程:
- E1消耗ATP形成酰基-腺苷酸中介物使泛素C端活化
- 转移活化的泛素分子与E2的半胱氨酸残基结合
- 由E3催化使得泛素羧基和靶蛋白侧链赖氨酸残基形成异肽键.同一个蛋白的多个赖氨酸可重复泛素化.
蛋白酶体
是降解细胞内蛋白质大分子的复合体
由50种亚基组成,2000~2400KDa
有蛋白酶活性
- 哺乳动物的主要蛋白酶体:26s蛋白酶体
- 20s核心(催化核心):
由α,β,以α-β-β-α排列成四层中空环状结构
- α环为骨架,β环有蛋白酶活性
- 19s帽(调节亚基):
有两个,起识别泛素化蛋白的作用,切除泛素化修饰,使蛋白质去折叠
与20s核心相连6种亚基有ATP酶活性
- 唯一耗能步骤:使蛋白质去折叠并进一步传递至20s核心
- 识别并降解错误折叠或不稳定的蛋白
- 泛素化的蛋白酶体所介导的蛋白质降解途径
- 功能包括:
蛋白质质量检测,影响细胞代谢,信号转导,受体调整,免疫反应,细胞周期的调控,转录调节,DNA修复
- 识别并降解错误折叠或不稳定的蛋白
 3. 帮助变性或错误折叠的蛋白质正确折叠
3. 帮助变性或错误折叠的蛋白质正确折叠> 主要依靠热激蛋白(HSP,heat shock protein) - HSP - 高度保守 - 作为分子伴侣发挥多种作用 - 协助胞内蛋白合成 - 蛋白分选 - 蛋白折叠 - 蛋白装配 - 蛋白稳态 - 分为:Hsp100 ,Hsp90 ,Hsp70 ,Hsp60 和小分子Hsp - Hsp选择性的和畸形蛋白形成聚合物,利用水解ATP的能量使聚集的蛋白质溶解并进一步正确折叠

